Anti ebv igg ebna підвищений. Вірус Епштейна-Барр - симптоми, лікування, антитіла до вірусу. Як визначити наявність інфекції.
Які захворювання можуть викликати вірус Епштейна-Барра? Які симптоми типові для ВЕБ-інфекції?
Чи існують строго специфічні для ВЕБ зміни лабораторних показників?
Що включає в себе комплексна терапія ВЕБ-інфекції?
В останні роки спостерігається зростання числа хворих, що страждають хронічними рецидивуючими інфекціями, які в багатьох випадках супроводжуються вираженим порушенням загального самопочуття і цілим рядом терапевтичних скарг. Найбільш широко поширені в клінічній практиці (частіше викликається Herpes Simplex I), (Herpes zoster) і (частіше викликається Herpes simplex II); в трансплантології і гінекології часто зустрічаються захворювання і синдроми, викликані цитомегаловірусом (Cytomegalovirus). Однак про хронічної інфекції, Викликаної вірусом Епштейна-Барр (ВЕБ), і її формах лікарі загальної практики обізнані явно недостатньо.
ВЕБ був вперше виділений з клітин лімфоми Беркетта 35 років тому. Незабаром стало відомо, що вірус може викликати у людини гострий і. В даний час встановлено, що ВЕБ асоційований з цілим рядом онкологічних, переважно лімфопроліферативних і аутоімунних захворювань (класичні, і ін.). Крім того, ВЕБ може викликати хронічні маніфестних і стерті форми захворювання, що протікають по типу хронічного мононуклеозу. Вірус Епштейна-Барр відноситься до сімейства герпес-вірусів, підродина гамма-герпес-вірусів і рід лімфокріптовірусов, містить дві молекули ДНК і має здатність, як і інші віруси цієї групи, довічно персистувати в організмі людини. У частини хворих на фоні імунної дисфункції і спадкової схильності до тієї чи іншої патології ВЕБ може викликати різні захворювання, про які згадувалося вище. ВЕБ інфікує людини, проникаючи через інтактні епітеліальні шари шляхом трансцитозу в нижележащую лімфоїдну тканину мигдаликів, зокрема В-лімфоцити. Проникнення ВЕБ в В-лімфоцити здійснюється через рецептор цих клітин CD21 - рецептор до С3d-компоненту комплементу. Після інфікування число уражених клітин збільшується за допомогою вірус-залежною клітинної проліферації. Інфіковані В-лімфоцити можуть значний час перебувати в тонзіллярних криптах, що дозволяє вірусу виділятися в зовнішнє середовище зі слиною.
З інфікованими клітинами ВЕБ розповсюджується по іншим лімфоїдним тканинам і периферичної крові. Дозрівання В-лімфоцитів у плазматичні клітини (що відбувається в нормі при їх зустрічі з відповідним антигеном, інфектом) стимулює розмноження вірусу, а подальша загибель (апоптоз) цих клітин призводить до виділення вірусних частинок в крипти і слину. В інфікованих вірусом клітинах можливо два види розмноження: литический, тобто приводить до загибелі, лизису, клітини-господаря, і латентний, коли число вірусних копій невелике і клітина не руйнується. ВЕБ може тривалий час перебувати в В-лімфоцитах і епітеліоцитах назофарингеальної області і слинних залоз. Крім того, він здатний інфікувати інші клітини: Т-лімфоцити, NK-клітини, макрофаги, нейтрофіли, епітеліоцити судин. У ядрі клітини-господаря ДНК ВЕБ може формувати кільцеву структуру - Епіс, або вбудовуватися в геном, викликаючи хромосомні порушення.
При гострій або активної інфекції переважає литическая реплікація вірусу.
Активне розмноження вірусу може відбуватися в результаті ослаблення імунологічного контролю, а також стимуляції розмноження клітин, інфікованих вірусом під дією цілого ряду причин: гострої бактеріальної або вірусної інфекції, Вакцинації, стресів і ін.
За даними більшості дослідників, сьогодні приблизно 80-90% населення інфіковано ВЕБ. Первинна інфекція найчастіше виникає в дитячому або молодому віці. Шляхи передачі вірусу різні: повітряно-крапельний, контактно-побутовий, трансфузійний, статевої, трансплацентарний. Після зараження ВЕБ реплікація вірусу в організмі людини і формування імунної відповіді можуть протікати безсимптомно або проявлятися у вигляді незначних ознак ГРВІ. Але при попаданні великої кількості инфекта і / або наявності в даний період значного ослаблення імунної системи у пацієнта може розвинутися картина інфекційного мононуклеозу. Можливо кілька варіантів наслідків гострого інфекційного процесу:
- одужання (ДНК вірусу можна виявити тільки при спеціальному дослідженні в одиничних В-лімфоцитах або епітеліальних клітинах);
- безсимптомне вірусоносійство або латентна інфекція (вірус визначається в слині або лімфоцитах при чутливості методу ПЛР 10 копій в пробі);
- хронічна рецидивуюча інфекція: а) хронічна активна ВЕБ-інфекція за типом хронічного інфекційного мононуклеозу; б) генералізована форма хронічної активної ВЕБ-інфекції з ураженням ЦНС, міокарда, нирок і ін .; в) ВЕБ-асоційований гемофагоцитарний синдром; г) стерті або атипові форми ВЕБ-інфекції: тривалий субфебрилітет неясного генезу, клініка - рецидивні бактеріальні, грибкові, часто мікст-інфекції респіраторного і шлунково-кишкового тракту, І інші прояви;
- розвиток онкологічного (лімфопроліферативного) процесу (множинні поліклональні, назофарингеального карцинома, лейкоплакії мови і слизових ротової порожнини, і кишечника і ін.);
- розвиток аутоімунного захворювання -, і ін. (слід зазначити, що дві останні групи захворювань можуть розвиватися через великий проміжок часу після інфікування);
- згідно з результатами досліджень нашої лабораторії (і на підставі ряду зарубіжних публікацій), ми зробили висновок, що ВЕБ може грати важливу роль у виникненні.
Найближчий і віддалений прогноз для хворого з гострою інфекцією, викликаною ВЕБ, залежить від наявності та ступеня вираженості імунної дисфункції, генетичної схильності до тих чи інших ВЕБ-асоційованим захворюванням (див. Вище), а також від наявності ряду зовнішніх чинників (стреси, інфекції, операційні втручання, несприятливий вплив довкілля), Що ушкоджують імунну систему. Було виявлено, що ВЕБ володіє великим набором генів, що дає йому можливість в певній мірі вислизати від імунної системи людини. Зокрема, ВЕБ виробляє білки - аналоги ряду людських інтерлейкінів і їх рецепторів, що змінюють імунну відповідь. В період активного розмноження вірус продукує ІЛ-10-подібний білок, який пригнічує Т-клітинний імунітет, функцію цитотоксичних лімфоцитів, макрофагів, порушує всі етапи функціонування природних кілерів (тобто найважливіших систем противірусного захисту). Інший вірусний білок (BI3) також може пригнічувати Т-клітинний імунітет і блокувати активність клітин-кілерів (через придушення інтерлейкіну-12). Ще одна властивість ВЕБ, як і інших герпес-вірусів, висока Мутабельность, дозволяє йому на певний час уникати впливу специфічних імуноглобулінів (які були напрацьовані до вірусу до його мутації) і клітин імунної системи господаря. Таким чином, розмноження ВЕБ в організмі людини може з'явитися причиною посилення (виникнення) вторинного імунодефіциту.
Клінічні форми хронічної інфекції, викликаної вірусом Епштейна-Барр
Хронічна активна ВЕБ-інфекція (ХА ВЕБІ) характеризується тривалим рецидивуючим перебігом і наявністю клінічних та лабораторних ознак вірусної активності. Пацієнтів турбують слабкість, пітливість, нерідко - болі в м'язах і суглобах, наявність шкірних висипань, Кашель, утруднене носове дихання, дискомфорт в горлі, болі, важкість у правому підребер'ї, перш нехарактерні для даного хворого головний біль, запаморочення, емоційна лабільність, депресивні розлади, порушення сну, зниження пам'яті, уваги, інтелекту. часто спостерігаються субфебрильна температура, Збільшення лімфовузлів, гепатоспленомегалія різного ступеня вираженості. Нерідко ця симптоматика має хвилеподібний характер. Іноді хворі описують свій стан як хронічний грип.
У значної частини хворих з ХА ВЕБІ спостерігається приєднання інших герпетичних, бактеріальних і грибкових інфекцій (, запальні захворювання верхніх дихальних шляхів і шлунково-кишкового тракту).
ХА ВЕБІ характеризується лабораторними (непрямими) ознаками вірусної активності, а саме відносним і абсолютним лімфомоноцитозом, наявністю атипових мононуклеарів, рідше моноцитозом і лимфопенией, в ряді випадків анемією і тромбоцитозом. При дослідженні імунного статусу у хворих ХА ВЕБІ спостерігаються зміна змісту і функції специфічних цитотоксичних лімфоцитів, природних кілерів, порушення специфічного гуморального відповіді (дісіммуноглобулінемія, тривала відсутність напрацювання імуноглобуліну G (IgG) або так зване відсутність сероконверсии до пізнього нуклеарного антигену вірусу - EBNA, що відображає неспроможність імунологічного контролю розмноження вірусу. Крім того, за нашими даними, більш ніж у половини хворих знижена здатність до стимульованої продукції інтерферону (ІФН), підвищений вміст сироваткового ІФН, мають місце дісіммуноглобулінемія, порушення авідності антитіл (їх здатності міцно зв'язуватися з антигеном), зменшено змісту DR + лімфоцитів, нерідко підвищені показники циркулюючих імунних комплексів і антитіл до ДНК.
У осіб з вираженою імунною недостатністю можливо виникнення генералізованих форм ВЕБ-інфекції з ураженням центральної та периферичної нервової систем (розвиток, енцефаліту, атаксії мозочка, полирадикулоневритов), а також з ураженням інших внутрішніх органів (розвиток, лимфоцитарного інтерстиціального пневмоніту, важких форм). Генералізовані форми ВЕБ-інфекції нерідко закінчуються летальним результатом.
ВЕБ-асоційований гемофагоцитарний синдром характеризується розвитком анемії або панцитопенії. Часто поєднується з ХА ВЕБІ, інфекційний мононуклеоз та лімфопроліферативні захворювання. У клінічній картині переважають интермиттирующая лихоманка, гепатоспленомегалія, лімфаденопатія, панцитопенія або виражена анемія, печінкова дисфункція, коагулопатія. Гемофагоцитарний синдром, що розвивається на тлі інфекційного мононуклеозу, характеризується високою летальністю (до 35%). Вищеописані зміни пояснюють гіперпродукцією прозапальних цитокінів (ФНП, ІЛ1 і ряду інших) Т-клітинами, інфікованими вірусом. Ці цитокіни активують систему фагоцитів (розмноження, диференціювання і функціональну активність) в кістковому мозку, периферичної крові, печінки, селезінці, лімфовузлах. Активовані моноцити і гістіоцити починають поглинати клітини крові, що призводить до їх руйнування. Більш тонкі механізми цих змін знаходяться в стадії вивчення.
Стерті варіанти хронічної ВЕБ-інфекції
За нашими даними, ХА ВЕБІ нерідко протікає стерто або під масками інших хронічних захворювань.
Можна виділити дві найбільш часто зустрічаються форми латентної млявою ВЕБ-інфекції. У першому випадку хворих турбує тривалий субфебрилітет неясного генезу, слабкість, болі в периферичних лімфовузлах, міалгії, артралгії. Характерна також волнообразность симптоматики. В іншої категорії хворих крім вищеописаних скарг мають місце маркери вторинного імунодефіциту у вигляді раніше нехарактерних для них частих інфекцій дихальних шляхів, шкіри, шлунково-кишкового тракту, геніталій, які на тлі терапії повністю не проходять або ж швидко рецидивують. Найбільш часто в анамнезі цих пацієнтів мають місце тривалі стресові ситуації, надмірні психічні та фізичні перевантаження, рідше - захоплення голодуванням, модними дієтами і т. Д. Нерідко вищеописане стан розвивалося після перенесеної ангіни, ГРЗ, гриппоподобного захворювання. Характерними для цього варіанту інфекції також є стійкість і тривалість симптоматики - від шести місяців до 10 і більше років. При повторних обстеженнях виявляють ВЕБ в слині і / або лімфоцитах периферичної крові. Як правило, повторні поглиблені обстеження, що проводяться у більшості цих пацієнтів, не дозволяють виявити інших причин тривалого субфебрилітету і розвитку вторинного імунодефіциту.
Дуже важливий для постановки діагнозу ХА ВЕБІ є і той факт, що в разі стійкого придушення вірусної реплікації вдається досягти тривалої ремісії у більшості пацієнтів. Діагностика ХА ВЕБІ утруднена через відсутність специфічних клінічних маркерів захворювання. Певний «внесок» в гіподіагностики вносить і недостатня інформованість практичних лікарів про даної патології. Проте, з огляду на прогресуючий характер ХА ВЕБІ, а також серйозність прогнозу (ризик розвитку лімфопроліферативних і аутоімунних захворювань, висока летальність при розвитку гемофагоцитарний синдрому), при підозрі на ХА ВЕБІ необхідно проводити відповідне обстеження. Найбільш характерний клінічний симптомокомплекс при ХА ВЕБІ - це тривалий субфебрилітет, слабкість і зниження працездатності, болі в горлі, лімфаденопатія, гепатоспленомегалія, печінкова дисфункція, психічні порушення. Важливим симптомом є відсутність повного клінічного ефекту від проведення загальноприйнятої терапії астенічного синдрому, загальнозміцнюючий терапії, а також від призначення антибактеріальних препаратів.
При проведенні диференціальної діагностики ХА ВЕБІ в першу чергу слід виключити такі захворювання:
- інші внутрішньоклітинні, в тому числі вірусні інфекції: ВІЛ, вірусні гепатити, цитомегаловирусную інфекцію, токсоплазмоз та ін .;
- ревматичні захворювання, в тому числі і асоційовані з ВЕБ-інфекцією;
- онкологічні захворювання.
Лабораторні дослідження в діагностиці ВЕБ-інфекції
- Клінічний аналіз крові: можуть спостерігатися незначний лейкоцитоз, лімфомоноцитоз з атиповими мононуклеарами, в ряді випадків гемолітична анемія внаслідок гемофагоцитарний синдрому або аутоімунна анемія, можливо, тромбоцитопенія або тромбоцитоз.
- Біохімічний аналіз крові: виявляються підвищення рівня трансаміназ, ЛДГ та інших ферментів, білків гострої фази, таких, як СРБ, фібриноген та ін.
Як уже згадувалося вище, всі перераховані зміни не є строго специфічними для ВЕБ-інфекції (їх можна виявити і при інших вірусних інфекціях).
- Імунологічне обстеження: бажано оцінити основні показники противірусного захисту: стан системи інтерферону, рівень імуноглобулінів основних класів, зміст цитотоксичних лімфоцитів (CD8 +), Т-хелперів (CD4 +).
За нашими даними, в імунному статусі при ВЕБ-інфекції зустрічаються два види змін: підвищена активність окремих ланок імунної системи та / або дисбаланс і недостатність інших. Ознаками напруженості противірусного імунітету можуть бути підвищені рівні ІФН в сироватці крові, IgА, IgМ, IgЕ, ЦВК, нерідко - поява антитіл до ДНК, підвищення вмісту природних кілерів (CD16 +), Т-хелперів (CD4 +) і / або цитотоксичних лімфоцитів (CD8 +) . Система фагоцитів може бути активована.
У свою чергу, імунна дисфункція / недостатність при цій інфекції проявляється зниженням здатності до стимульованої продукції ІФН альфа і / або гамма, дісіммуноглобулінеміі (зниження вмісту IgG, рідше IgА, підвищення вмісту Ig М), зниженням авідності антитіл (їх здатності міцно зв'язуватися з антигеном) , зниженням змісту DR + лімфоцитів, CD25 + лімфоцитів, тобто активованих Т-клітин, зменшенням числа і функціональної активності природних кілерів (CD16 +), Т-хелперів (CD4 +), цитотоксичних Т-лімфоцитів (CD8 +), зниженням функціональної активності фагоцитів і / або зміною (збоченням) їх реакції на стимули, в тому числі на імунокоректори.
- Серологічні дослідження: підвищення титрів антитіл (АТ) до антигенів (АГ) вірусу є критерієм наявності інфекційного процесу в даний час або свідоцтвом контакту з інфекцією в минулому. При гострій ВЕБ-інфекції, в залежності від стадії хвороби, в крові визначаються різні класи АТ до АГ вірусу, відбувається зміна «ранніх» АТ на «пізні».
Специфічні IgM-АТ з'являються в гострій фазі захворювання або в період загострення і через чотири-шість тижнів, як правило, зникають. IgG-АТ до ЕА (ранні) також з'являються в гострій фазі, є маркерами активної реплікації вірусу і при одужанні знижуються за три-шість місяців. IgG-АТ до VCA (ранні) визначаються в гострому періоді з максимумом до другої-четвертому тижні, потім їх кількість знижується, і пороговий рівень зберігається тривалий час. IgG-АТ до EBNA виявляються через два - чотири місяці після гострої фази, і їх вироблення зберігається протягом усього життя.
За нашими даними, при ХА ВЕБІ більш ніж у половини хворих в крові визначаються «ранні» IgG-АТ, в той час як специфічні IgM-АТ визначаються значно рідше, при цьому зміст пізніх IgG-АТ до EBNA коливається в залежності від стадії загострення і стану імунітету.
Треба відзначити, що проведення серологічного дослідження в динаміці допомагає в оцінці стану гуморального відповіді і ефективності противірусної і імунокорекції.
- ДНК-діагностика ХА ВЕБІ. За допомогою методу полімеразної ланцюгової реакції (ПЛР) визначення ДНК ВЕБ проводять в різних біологічних матеріалах: слині, сироватці крові, лейкоцитах і лімфоцитах периферичної крові. При необхідності проводять дослідження в біоптатах печінки, лімфовузлів, слизової кишечника і т. Д. Метод ПЛР-діагностики, який характеризується високою чутливістю, знайшов застосування в багатьох областях, наприклад в криміналістиці: зокрема, в тих випадках, коли необхідно ідентифікувати мінімальні слідові кількості ДНК .
Використання даного методу в клінічній практиці для виявлення того чи іншого внутрішньоклітинного агента через занадто високою його чутливості нерідко утруднено, так як немає можливості відрізнити здорове носійство (мінімальна кількість инфекта) від проявів інфекційного процесу з активним розмноженням вірусу. Тому для клінічних досліджень використовують ПЛР-методику із заданою, нижчою чутливістю. Як показали наші дослідження, застосування методики з чутливістю 10 копій в пробі (1000 ГЕ / мл в 1 мл зразка) дозволяє виявляти здорових носіїв ВЕБ, в той час як зниження чутливості методу до 100 копій (10000 ГЕ / мл в 1 мл зразка) дає можливість діагностувати осіб з клініко-імунологічними ознаками ХА ВЕБІ.
Ми спостерігали хворих з наявністю клінічних та лабораторних даних (в тому числі результатів серологічних досліджень), характерних для вірусної інфекції, у яких при первинному обстеженні аналіз на ДНК ВЕБ у слині і клітинах крові був негативним. Важливо відзначити, що в цих випадках не можна виключити реплікацію вірусу в шлунково-кишковому тракті, кістковому мозку, шкірі, лімфовузлах і ін. Тільки повторне обстеження в динаміці може підтвердити або виключити наявність або відсутність ХА ВЕБІ.
Таким чином, для постановки діагнозу ХА ВЕБІ крім проведення загальноклінічного обстеження необхідні дослідження імунного статусу (противірусного імунітету), ДНК, діагностика інфекції в різних матеріалах в динаміці, серологічні дослідження (ІФА).
Лікування хронічної Епштейн-Барр-вірусної інфекції
В даний час загальноприйнятих схем лікування ХА ВЕБІ не існує. Однак сучасні уявлення про вплив ВЕБ на організм людини і дані про наявний ризик розвитку серйозних, нерідко фатальних захворювань показують необхідність проведення терапії і диспансерного спостереження у хворих, які страждають ХА ВЕБІ.
Дані літератури і досвід нашої роботи дозволяють дати патогенетично обґрунтовані рекомендації по терапії ХА ВЕБІ. У комплексному лікуванні даного захворювання використовують такі препарати:
- , В ряді випадків в поєднанні з індукторами ІФН - (створення антивірусного стану незаражених клітин, придушення розмноження вірусу, стимуляція природних кілерів, фагоцитів);
- аномальні нуклеотиди (пригнічують розмноження вірусу в клітці);
- імуноглобуліни для внутрішньовенного введення (Блокада «вільних» вірусів, що знаходяться в міжклітинної рідини, лімфі і крові);
- аналоги тимических гормонів (сприяють функціонуванню Т-ланки, крім того, стимулює фагоцитоз);
- глюкокортикоїди і цитостатики (зменшують реплікацію вірусу, запальну реакцію і пошкодження органів).
Інші групи ліків, як правило, грають допоміжну роль.
До початку лікування бажано обстежити членів сім'ї хворого на предмет виділення вірусів (зі слиною) і можливості повторного інфікування пацієнта, при необхідності придушення вірусної реплікації проводять і у членів сім'ї.
- Обсяг терапії хворих з хронічною активною ВЕБ-інфекцією (ХА ВЕБІ) може бути різним, залежно від тривалості захворювання, тяжкості стану та імунних розладів. Лікування починають з призначення антиоксидантів і проведення детоксикації. У середньо-і важких випадках початкові етапи терапії бажано проводити в умовах стаціонару.
Препаратом вибору є інтерферон-альфа, в середньо випадках призначається у вигляді монотерапії. Добре зарекомендував себе (в тому, що стосується біологічної активності і переносимості) вітчизняний рекомбінантний препарат реаферон, при цьому вартість його істотно нижче, ніж у зарубіжних аналогів. Використовувані дози ІФН-альфа розрізняються залежно від ваги, віку, переносимості препарату. Мінімальні дози - 2 млн. ОД на добу (по 1 млн. ОД двічі на день внутрішньом'язово), перший тиждень щодня, потім три рази в тиждень протягом трьох-шести місяців. Оптимальні дози - 4-6 млн. ОД (по 2-3 млн. ОД двічі на день).
ІФН-альфа, як прозапальний цитокин, може викликати грипоподібні симптоматику (лихоманка, головний біль, запаморочення, міалгії, артралгії, вегетативні розлади - зміна АТ, ЧСС, рідше диспептичні явища).
Виразність зазначених симптомів залежить від дози та індивідуальної переносимості препарату. Це минущі симптоми (зникають через 2-5 днів від початку лікування), і частина з них контролюється призначенням нестероїдних протизапальних засобів. При лікуванні препаратами ІФН-альфа можуть виникати оборотні тромбоцитопенія, нейтропенія, шкірні реакції (свербіж, висипи різноманітного характеру), рідко - алопеція. Тривале застосування ІФН-альфа в великих дозах може призвести до імунної дисфункції, клінічно проявляється фурункульозом, іншими гнійничкові і вірусними ураженнями шкіри.
У середньо-і важких випадках, а також при неефективності препаратів ІФН-альфа до лікування необхідно підключати аномальні нуклеодіти - валацикловір (валтрекс), ганцикловір (цимевен) або фамцикловір (фамвір).
Курс лікування аномальними нуклеотидами повинен становити не менше 14 днів, перші сім днів бажано внутрішньовенне введення препарату.
У випадках тяжкого перебігу ХА ВЕБІ в комплексну терапію включають також препарати імуноглобулінів для внутрішньовенного введення в дозі 10-15 г. При необхідності (за результатами імунологічного обстеження) - призначають імунокоректори з Т-активує здатністю або заміщають тіміческіе гормони (тимоген, иммунофан, тактовно, і ін.) протягом одного-двох місяців з поступовою відміною або переходом на підтримуючі дози (два рази на тиждень).
Лікування ВЕБ-інфекції необхідно проводити під контролем клінічного аналізу крові (один раз в 7-14 днів), біохімічного аналізу (один раз на місяць, при необхідності частіше), імунологічного дослідження - через один-два місяці.
- Лікування хворих з генералізованою ВЕБ-інфекцією проводиться в стаціонарі, спільно з невропатологом.
До противірусної терапії препаратами ІФН-альфа і аномальними нуклеотидами в першу чергу підключають системні кортикостероїди в дозах: парентеральний (в перерахунку на преднізолон) 120-180 мг на добу, або 1,5-3 мг / кг, можливе використання пульс-терапії метипредом 500 мг в / в крапельно, або всередину по 60-100 мг на добу. Внутрішньовенно вводять плазму і / або препарати імуноглобулінів для внутрішньовенного введення. При вираженій інтоксикації показані введення детоксицирующих розчинів, плазмаферез, гемосорбція, призначення антиоксидантів. У важких випадках застосовують цитостатики: етопозид, циклоспорин (сандиммун або консупрен).
- Лікування хворих ВЕБ-інфекцією, ускладненою УКРІНФОРМ, необхідно проводити в стаціонарі. Якщо провідним у клінічній картині і прогнозі життя є УКРІНФОРМ, терапію починають з призначення великих доз кортикостероїдів (блокада продукції прозапальних цитокінів і фагоцитарної активності), в найбільш важких випадках з цитостатиками (етопозид, циклоспорин) на тлі застосування аномальних нуклеотидів.
- Лікування хворих з латентною стертою ВЕБ-інфекцією може проводитися амбулаторно; терапія включає призначення інтерферону-альфа (можливо чергування з препаратами індукторів ІФН). При недостатній ефективності підключають аномальні нуклеотиди, препарати імуноглобулінів для внутрішньовенного введення; за результатами імунологічного обстеження призначають імунокоректори (Т-активатори). У випадках так званого «носійства», або «безсимптомною латентної інфекції» з наявністю специфічної імунної відповіді на розмноження вірусу проводиться спостереження та лабораторний контроль (клінічний аналіз крові, біохімія, ПЛР-діагностика, імунологічне обстеження) через три-чотири місяці.
Лікування призначають при появі клініки ВЕБ-інфекції або при формуванні ознак ВИД.
Проведення комплексної терапії з включенням зазначених вище препаратів дозволяє домогтися ремісії захворювання у частини пацієнтів з генералізованою формою захворювання і при гемофагоцитарний синдромі. У хворих із середньотяжким проявами ХА ВЕБІ і в випадках стертого перебігу захворювання ефективність терапії вище (70-80%) крім клінічного ефекту часто вдається домогтися придушення реплікації вірусу.
Після придушення розмноження вірусу і отримання клінічного ефекту важливо продовжити ремісію. Показано проведення санаторно-курортного лікування.
Хворих слід інформувати про важливість дотримання режиму праці та відпочинку, повноцінного харчування, обмеження / припинення прийому алкоголю; при наявності стресових ситуацій необхідна допомога психотерапевта. Крім того, при необхідності проводять підтримуючу імунокоригуючою терапію.
Таким чином, лікування хворих з хронічною Епштейн-Барр-вірусної інфекцією є комплексним, проводиться під лабораторним контролем і включає застосування препаратів інтерферону-альфа, аномальних нуклеотидів, иммунокорректоров, замісних імунотропних препаратів, глюкокортикоїдних гормонів, симптоматичних засобів.
література
- Гурцевіч В. Е., Афанасьєва Т. А. Гени латентної інфекції Епштейна-Барр (ВЕБ) і їх роль у виникненні неоплазий // Русский журнал<ВИЧ/СПИД и родственные проблемы>. 1998; Т. 2, № 1: 68-75.
- Дідковський Н. А., Малашенкова І. К., Тазулахова Е. Б. Індуктори інтерферону - новий перспективний клас імммуномодуляторов // Алергологія. 1998. № 4. С. 26-32.
- Єгорова О. Н., Балабанова Р.М., Чувіров Г. Н. Значення антитіл до герпетичних вірусів, які визначаються у хворих з ревматичними захворюваннями // Терапевтичний архів. 1998. № 70 (5). С. 41-45.
- Малашенкова І. К., Дідковський Н. А., Говорун В. М., Ільїна Є. М., Тазулахова Е. Б., Бєлікова М. М., Щепеткова І. Н. До питання про роль вірусу Епштейна-Барр в розвитку синдрому хронічної втоми та імунної дисфункції.
- Christian Brander and Bruce D Walker Modulation of host immune responses by clinically relevant human DNA and RNA viruses // Current Opinion in Microbiology 2000, 3: 379-386.
- Cruchley A. T., Williams D. M., Niedobitek G. Epstein-Barr virus: biology and disease // Oral Dis 1997 May; 3 Suppl 1: S153-S156.
- Glenda C. Faulkner, Andrew S. Krajewski and Dorothy H. CrawfordA The ins and outs of EBV infction // Trends in Microbiology. 2000, 8: 185-189.
- Jeffrey I. Cohen The biology of Epstein-Barr virus: lessons learned from the virus and the host // Current Opinion in Immunology. 1999. 11: 365-370.
- Kragsbjerg P. Chronic active mononucleosis // Scand. J. Infect. Dis. 1997. 29 (5): 517-518.
- Kuwahara S., Kawada M., Uga S., Mori K. A case of cerebellar meningo-encephalitis caused by Epstein-Barr virus (EBV): usefulness of Gd-enhanced MRI for detection of the lesions // No To Shinkei. 2000. Jan. 52 (1): 37-42.
- Lekstron-Himes J. A., Dale J. K., Kingma D. W. Periodic illness assotiated with Epstein-Barr virus infection // Clin. Infect. Dis. Jan. 22 (1): 22-27.
- Okano M. Epstein-Barr virus infecion and its role in the expanding spectrum of human diseases // Acta Paediatr. 1998. Jan; 87 (1): 11-18.
- Okuda T., Yumoto Y. Reactive hemophagocytic syndromeresponded to combination chemotherapy with steroid pulse therapy // Rinsho Ketsueki. 1997. Aug; 38 (8): 657-62.
- Sakai Y., Ohga S., Tonegawa Y. Interferon-alpha therapy for chronic active Epstein-Barr virus infection // Leuk. Res. 1997. Oct; 21 (10): 941-50.
- Yamashita S., Murakami C., Izumi Y. Severe chronic active Epstein- Barr virus infection accompanied by virus-associated hemophagocytic syndrome, cerebellar ataxia and encephalitis // Psychiatry Clin. Neurosci. 1998. Aug; 52 (4): 449-52.
І. К. Малашенкова, кандидат медичних наук
Н. А. Дідковський, доктор медичних наук, професор
Ж. Ш. Сарсанія, кандидат медичних наук
М. А. Жарова, Є. М. Литвиненко, І. Н. Щепеткова, Л. І. Чистова, О. В. Пичужкина
НДІ фізико-хімічної медицини МОЗ РФ
Т. С. Гусєва, О. В. Паршина
ГУНІІ епідеміології та мікробіології ім. Н. Ф. Гамалії РАМН, Москва
Клінічна ілюстрація випадку хронічної активної ВЕБ-інфекції з гемофагоцитарний синдромом
Хвора І. Л., 33 років, звернулася в лабораторію клінічної імунології НДІ ФХМ 20.03.97 зі скаргами на тривалий субфебрилітет, виражену слабкість, Пітливість, болі в горлі, сухий кашель, головний біль, задишку при русі, прискорене серцебиття, порушення сну, емоційна лабільність (підвищену дратівливість, образливість, плаксивість), забудькуватість.
З анамнезу: восени 1996 року після важкої ангіни (супроводжувалася сильною лихоманкою, інтоксикацією, лимфоаденопатией) виникли вищевказані скарги, які тривалий час зберігалися збільшення ШОЕ, зміни лейкоцитарної формули (моноцитоз, лейкоцитоз), була виявлена \u200b\u200bанемія. Амбулаторне лікування (антибіотикотерапія, сульфаніламіди, препарати заліза та ін.) Виявилося неефективним. Стан прогресивно погіршувався.
При надходженні: t тіла - 37,8 ° С, шкірні покриви підвищеної вологості, виражена блідість шкіри і слизових оболонок. Лімфовузли (підщелепні, шийні, пахвові) збільшені до 1-2 см, плотноеластіческойконсистенції, хворобливі, не спаяні з навколишніми тканинами. Зів гипереміровані, набряклий, явища фарингіту, мигдалини збільшені, пухкі, помірно гіперемована, язик обкладений біло-сірим нальотом, гиперемирован. У легенях дихання з жорстким відтінком, розсіяні сухі хрипи на вдиху. Межі серця: ліва збільшена на 0,5 см вліво від среднеключичной лінії, тони серця збережені, короткий систолічний шум над верхівкою, ритм неправильний, екстрасистолія (5-7 в хв), ЧСС - 112 за хв, АТ - 115/70 мм рт ст. Живіт роздутий, помірно болючий при пальпації в правому підребер'ї і по ходу товстої кишки. За даними УЗД органів черевної порожнини, Незначне збільшення розмірів печінки і - в дещо більшою мірою - селезінки.
З лабораторних аналізів звертали на себе увагу нормохромнаяанемія зі зниженням Hb до 80 г / л з анизоцитозом, кількості, поліхроматофілія еритроцитів; ретикулоцитоз, нормальний вміст сироваткового заліза (18,6 мкм / л), негативна реакція Кумбса. Крім того, спостерігалися лейкоцитоз, тромбоцитоз і моноцитоз з великою кількістю атипових мононуклеарів, прискорення ШОЕ. У біохімічних аналізах крові відзначалися помірне підвищення трансаміназ, КФК. ЕКГ: ритм синусовий, неправильний, передсердна і шлуночкова екстрасистолія, ЧСС до 120 в хвилину. Електрична вісь серця відхилена вліво. Порушення внутрішньошлуночкової провідності. Зниження вольтажу в стандартних відведеннях, дифузні зміни міокарда, в грудних відведеннях спостерігалися зміни, характерні для гіпоксії міокарда. Також був істотно порушений імунний статус - підвищений вміст імуноглобуліну М (IgМ) і знижено імуноглобулінів А і G (IgА і IgG), спостерігалося переважання продукції низькоавідних, тобто функціонально неповноцінних антитіл, дисфункція Т-ланки імунітету, підвищення рівня сироваткового ІФН, зниження здатності до продукції ІФН у відповідь на багато стимули.
У крові були підвищені титри IgG-антитіл до ранніх і пізніх вірусних антигенів (VCA, EA EBV). При вирусологическом дослідженні (в динаміці) методом полімеразної ланцюгової реакції (ПЛР) в лейкоцитах периферичної крові була виявлена \u200b\u200bДНК ВЕБ.
В цю та наступні госпіталізації проводилися поглиблене ревматологічне обстеження і онкологічний пошук, були виключені також інші соматичні та інфекційні захворювання.
Хворий були поставлені наступні діагнози: хронічна активна ВЕБ-інфекція, помірна гепатоспленомегалія, вогнищевий міокардит, соматогенно обумовлена \u200b\u200bперсистирующая; вірусассоціірованний гемофагоцитарний синдром. Імунодефіцитний стан; хронічний фарингіт, бронхіт змішаної вірусно-бактеріальної етіології; , Ентерит, дисбіоз кишкової флори.
Незважаючи на проведену бесіду, від введення глюкокортикоїдів і препаратів інтерферону-альфа хвора категорично відмовилася. Було проведено лікування, що включає противірусну терапію (виролекс внутрішньовенно протягом тижня, з переходом на зовиракс 800 мг 5 разів на день per os), імунокоригуючою терапію (тимоген по схемі, циклоферон 500 мг за схемою, иммунофан за схемою), замісну терапію (октагам по 2,5 г два рази внутрішньовенно крапельно), детоксикаційні заходи (інфузії гемодезу, ентеросорбція), антиоксидантну терапію (токоферрол, аскорбінова кислота), Використовували препарати-метаболіка (есенціале, рибоксин), призначалася вітамінотерапія (полівітаміни з мікроелементами).
Після проведеного лікування у хворої нормалізувалася температура, зменшилися слабкість, пітливість, покращилися деякі показники імунного статусу. Однак повністю придушити реплікацію вірусу не вдалося (ВЕБ продовжував визначатися в лейкоцитах). Клінічна ремісія тривала недовго - через півтора місяця настав повторне загострення. При дослідженні крім ознак активації вірусної інфекції, анемії, прискорення ШОЕ були виявлені високі титри антитіл до сальмонели. Проводилось амбулаторне лікування основного і супутнього захворювання. Важке загострення почалося в січні 1998 року після гострого бронхіту і фарингіту. За даними лабораторних досліджень, в цей період відзначалися ускладнення анемії (до 76 г / л) і зростання кількості випадків атипових мононуклеарів в крові. Зазначалося наростання гепатоспленомегалии, в мазку з зіву знайдені Chlamidia Trachomatis, золотистий стафілокок, стрептокок, в сечі - Ureaplasma Urealiticum, в крові виявлено суттєве підвищення титрів антитіл до EBV, CMV, вірусу простого герпесу 1-го типу (HSV 1). Таким чином, у хворої збільшувалося число супутніх інфекцій, що також свідчило про наростання недостатності імунітету. Проводилась терапія індукторами інтерферону, замісна терапія Т-активаторами, антиоксидантами, метаболіка, тривала детоксикація. Помітний клінічний і лабораторний ефект був досягнутий до червня 1998 року, пацієнтці рекомендовано продовжити метаболічну, антиоксидантну, іммунозаместітельная терапію (тимоген та ін.). При повторному дослідженні восени 1998 року в слині і лімфоцитах ВЕБ не виявлявся, хоча зберігалися помірна анемія і імунна дисфункція.
Таким чином, у хворої І., 33 років, гостра ВЕБ-інфекція прийняла хронічний перебіг, ускладнилася розвитком гемофагоцитарний синдрому. Незважаючи на те що вдалося досягти клінічної ремісії, хвора потребує динамічного спостереження з метою як контролю реплікації ВЕБ, так і своєчасної діагностики лімфопроліферативних процесів (з огляду на високий ризик їх розвитку).
Зверніть увагу!
- ВЕБ був вперше виділений з клітин лімфоми Беркетта 35 років тому.
- Вірус Епштейна-Барр відноситься до сімейства герпес-вірусів.
- Сьогодні приблизно 80-90% населення інфіковано ВЕБ.
- Розмноження ВЕБ в організмі людини може з'явитися причиною посилення (виникнення) вторинного імунодефіциту.
найбільше читають
- Показники коагуляційного гемостазу в оцінці ефективності лікування остеоартриту колінних суглобів Онкологія
Етіологія. Інфекційний мононуклеоз викликається вірусом Епштейна-Барр (ВЕБ) і характеризується лихоманкою, інтоксикацією, генералізованою лімфаденопатією, збільшенням печінки і селезінки. Сьогодні є наукові дані, які дозволяють розглядати це захворювання, як поліетіологічное, що викликається різними герпесвирусами (цитомегаловірус, вірус герпесу людини 6-го типу). Отримано докази змішаних форм герпесвірусного мононуклеозу: вірус Епштейна-Барр + цитомегаловірус, вірус Епштейна-Барр + вірус герпесу людини 6-го типу.
ВЕБ вражає епітеліальні клітини слизової оболонки дихальних шляхів, травного тракту, статевих органів, а також клітини імунної системи, зокрема В-лімфоцити. Передача вірусів відбувається через біологічні рідини і виділення: кров, сеча, слина, слізна рідина, грудне молоко, Амніотична рідина, відокремлюване піхви, сперма. Для ВЕБ характерний також повітряно-крапельний шлях передачі.
патогенез. Розрізняють первинну Епштейна-Барр вірусну інфекцію і реактивацію інфекції. У більшості випадків первинна інфекція характеризується асимптомной сероконверсією або проявляється легкими катаральними симптомами. У 10-20% первинна інфекція протікає у вигляді манифестного інфекційного мононуклеозу, в подальшому в 15-25% випадків відзначається хронічне або рецидивуючий перебіг інфекції. Персистенція інфекції призводить до виникнення імунної недостатності, яка є тим патогенетичним фоном, який формує контингент «часто хворіючих дітей».
Після потрапляння вірусу в епітелій слизової оболонки ротоглотокі і верхніх дихальних шляхів відбувається зараження лімфоцитів. Існують певні відмінності в інфікуванні епітеліоцитів і лімфоцитів. В епітеліоцитах вірус проходить повну реплікацію з утворенням великої кількості віріонів, лізосом епітеліоцитів з подальшим зараженням сусідніх клітин. При інфікуванні В-лімфоцитів лише в невеликому відсотку клітин вірус реплікується, а в інших - знаходиться в латентному стані. Найбільш вивченим є механізм взаємодії ВЕБ з В-лімфоцитами. У складі суперкапсиду вірусу є глікопротеїнові комплекси - gp350, 85, 25 і 42. При взаємодії з В-лімфоцитами провідну роль відіграє комплекс gp350, який за структурою має схожість з компонентом комплексу С3dg і взаємодіє з молекулою CD21 на поверхні В-лімфоцити, що є для нього рецептором. Шляхом такої взаємодії досягається адгезія вірусу до клітини і початок ендоцитозу. Для пенетрации вірусу в клітинну мембрану необхідна взаємодія інших глікопротеїнових комплексів з β-ланцюгом молекули HLA 2 класу, тоді як для взаємодії вірусу з епітеліоцитами необхідна присутність gp85, 25, для яких на них існує спеціальний рецептор.
На ранніх етапах інфікування можливе інфікування Т- і NК-клітин з розвитком хронічної ВЕБ-інфекції з персистированием вірусу в лімфоцитах. Здатність ВЕБ до персистенції, незважаючи на високу іммунногенность, вказує на те, що вірус виробив механізм ускользания від імунної відповіді. Експрессіруемий ВЕБ білок BCRF-1, по амінокислотної послідовності збігається з цитокіном IL-10 і викликає його мімікрію, сприяє тим самим придушення синтезу ІНФ-γ периферійними мононуклеарами. Інший експрессіруемий їм білок BARF-1 функціонує як розчинний рецептор до IL-1 і, пов'язуючи його, блокує активність ІФН γ. Це забезпечує ускользание вірусу від імунного нагляду при гострої інфекції і при її реактивації. Таким чином, ВЕБ-інфекція вважається захворюванням імунної системи з порушенням интерферонообразования, а імунодепресивну дію вірусу призводить до активації вторинної флори, залучаючи в процесі різні органи.
Для інфекційного мононуклеозу типова аутосенсібілізація лімфоцитів до екстрактів тканини вилочкової залози, селезінки, до препаратів нативної і денатурированной ДНК. Вірус персистує не тільки в B-лімфоцитах і епітеліоцитах назофарингеальної області, а й здатний інфікувати інші клітини: Т-лімфоцити, макрофаги, нейтрофіли, епітеліоцити судин. Оберігаючи інфіковані їм B-лімфоцити від апоптозу, вірус посилює проліферацію цих клітин, нове покоління B-клітин містить копій гена вірусу Епштейна-Барр в латентній формі, в результаті чого вірус може тривало персистувати в організмі, викликаючи імунодефіцитний стан.
Асоційований з ВЕБ інфекційний мононуклеоз може викликати ускладнення із залученням різних органів і систем, але в основному даний вірус вражає епітелій шлунково-кишкового тракту з потужно розвиненою лімфоїдної системою слизової оболонки; доведена патологічна роль ВЕБ-інфекції в патогенезі аутоімунного хронічного гастриту.
Ефективну імунну відповідь на впровадження вірусу Епштейна-Барр включає гуморальні і клітинні механізми. При первинній інфекції формуються нейтралізуючі антитіла, антитіла класу IgM і IgG до капсидному антигену, пізніше - до ранніх, мембранним і ядерних антигенів вірусу. Інфіковані вірусом клітини мигдаликів посилено синтезують прозапальні цитокіни: фактор некрозу пухлин-α, інтерлейкіни 1, 6, 8. У гостру фазу хвороби в крові хворих збільшується рівень інтерлейкіну 1, 2, інтерферону-γ. Тривала персистенція вірусу обумовлює імунодефіцитний стан організму.
Умовою формування рецидивуючого перебігу Епштейна-Барр вірусної інфекції у дітей є неадекватний цитокінової відповідь в гостру фазу інфекційного мононуклеозу, що характеризується недостатньою активацією синтезу прозапальних цитокінів (ТNF-α, IL-8, інтерферону-γ) при посиленій секреції протизапального цитокіну (IL-4) .
клініка.
При вивченні плацент, у яких виявляються морфологічні ознаки інфекцій, викликаних ДНК-вмісними вірусами, виявляються Епштейна-Барр моновірусная інфекція або вірус Епштейна-Барр в поєднанні з ВПГ і ЦМВ. При оцінці соматичного статусу дітей з перинатальною ВЕБ інфекцією найбільш часто спостерігалося гіпотрофірованіе, субфебрилітет, виражений катаральний синдром, гіперемія і зернистість зіва, лімфопроліферативних синдром. Неврологічна симптоматика проявлялася синдромом рухових порушень і гідроцефаліческім синдромом. При вивченні імунологічного статусу у них виявлено пригнічення Т-клітинної ланки імунітету (зниження відносної кількості CD3 +, CD4 +, CD8 + клітин) і деяке збільшення числа B-клітин (CD21 + клітин). При цьому кількість активованих клітин (CD25 +, CD71 +, CD95 +) залишалося на рівні вікової норми, що свідчило про відсутність активації Т-клітинних реакцій у відповідь на вірусну інфекцію.
При постнатальному зараженні протягом інкубаційного періоду інфекційного мононуклеозу, який становить від 4 до 7 тижнів, відбувається дисемінація вірусу в лімфоретікулярной системі, виникають проліферативні зміни лімфоїдної тканини. Основними симптомами захворювання є лихоманка, збільшення лімфатичних вузлів, ураження ротоглотки у вигляді тонзиліту, аденоідіта, мелкоточечной енантеми на м'якому небі, утруднення носового дихання, збільшення розмірів печінки і селезінки, зміни показників периферичної крові. Крім цього уражається шлунково-кишковий тракт і серцево-судинна система.
Тонзиліт може бути катаральним або виразково-некротичним; лімфатичні вузли більше 2 см, чітко контурируются у вигляді ланцюжків або пакетів, шкіра над ними не змінена, на дотик малоболезненни. Особа одутле, повіки пастозні. Гепатоліенальнийсиндром досягає максимуму до 3-7 дня хвороби і тримається протягом 6 тижнів, іноді розміри печінки залишаються збільшеними до 3 місяців. У розпал хвороби спостерігається підвищення титрів органних антитіл. Найбільш високі титри визначалися до тканин кишечника, печінки, селезінки і серця.
Для інфекційного мононуклеозу характерні зміни в гемограмі: помірний лейкоцитоз (до 15-30 * '10 9 / л), підвищення відносного і абсолютного кількості лімфоцитів, виявлення атипових мононуклеарів, помірне підвищення ШОЕ (до 20-30 мм / год). Атипові мононуклеари з'являються до другого тижня захворювання і зберігаються протягом 1-2 тижнів, іноді до 4-12 тижнів.
За сучасними уявленнями прийнято виділяти хронічне і рецидивуючий перебіг мононуклеозу. Про хронічної інфекції говорять тільки в тому випадку, коли у хворого не вдавалося виявити початок і попередню симптоматику інфекційного мононуклеозу. Затяжні і рецидивні форми хвороби можуть спостерігатися після гострого інфекційного мононуклеозу, що пов'язано з персистированием вірусу в організмі з подальшою реактивацией. клінічна картина після перенесеного інфекційного мононуклеозу може проявлятися протягом півроку і більше персистуючої або поворотній лихоманкою, інтоксикаційним синдромом (слабкість, млявість, головні болі), лімфопроліферативним і кардіальним синдромами (серцеві болі, метеочутливість, артралгії).
Персистенція вірусу Епштейна-Барр виявляється не тільки в лімфоїдної системі, а й у слизовій шлунка. За даними Г.В. Волинець з співавт. у 76,6% дітей з хронічними запальними захворюваннями верхніх відділів органів травлення була виявлена \u200b\u200bхронічна Епштейна-Барр вірусна інфекція, при цьому у 30,1% пацієнтів мала місце реплікація вірусу в слизовій оболонці шлунка.
Для верифікації аутоімунного хронічного гастриту у дітей визначалися антитіла до парієтальних клітин методом непрямої імунофлюоресценції і серологічні маркери ВЕБ інфекції: IgM до вірусного капсидному антигену, антитіла до раннього антигену ВЕБ, а також антитіла до ядерного антигену. У всіх дітей визначалися ДНК ВЕБ у крові і в біоптаті слизової оболонки шлунка методом ПЛР. Маркерами активної вірусної інфекції було виявлення IgM до вірусного капсидному антигену і IgG до раннього антигену ВЕБ, що служило підставою для адекватного вибору антивірусної і іммунооріентірованная терапії хворих на хронічний аутоімунним гастритом.
діагностика. Вірус Епштейна-Барр викликає синтез циркулюючих антитіл як до вірусу, так і до антигенів вівці, коні або еритроцитів корови. Це гетерофільних антитіла, які виявляються при аглютинації червоних клітин вівці або коні, відносяться переважно до класу IgM і визначаються в реакції Пауля-Буннеля. Наростання титру антитіл настає на 2-4 тижні захворювання.
Найбільшу значимість для серодиагностики Епштейна-Барр вірусної інфекції має метод імуноферментного аналізу з визначенням антитіл до наступних вірусних білків: раннього антигену, ядерного антигену і вірусного капсидному антигену вірусу Епштейна-Барр. Специфічність антитіл до різних антигенів вірусу допомагає відрізнити гостру або субклиническую інфекцію від анамнестичних. Так, IgM до капсидному антигену продукуються на ранніх стадіях хвороби і зникають надалі. Антитіла до ядерного антигену вірусу з'являються пізніше, в фазі одужання (через 4 місяці після інфекції) і залишаються на все життя. Антитіла до раннього антигену виникають при первинній інфекції у 70% хворих і вважаються транзиторним індикатором активної інфекції. Антитіла до раннього антигену можуть виявлятися у хворих в терміни від декількох місяців до року. При реактивації інфекції відбувається сероконверсія антитіл (IgG) до вірусного капсидному і ядерного антигенів.
Визначення сироваткових маркерів герпесвірусної інфекції не може служити специфічним тестом для диференціації первинної інфекції і реактивації. Єдиний спосіб, що дозволяє відразу і достовірно діагностувати первинну інфекцію, - визначення індексу авідності (ІА) специфічних антитіл. Для розмежування первинної інфекції, реінфекції і реактивації інфекційного процесу запропонований тест на визначення авідності IgG-антитіл.
Авідність - це міцність зв'язку між антигеном і антитілом. Величина авідності залежить від афінності специфічних антитіл і кількості зв'язують центрів. Афінність - це ступінь специфічного спорідненості активного центру до антигенної детермінанті.
Відомо, що імунна відповідь на першу зустріч з антигеном починається з продукції імуноглобулінів класу М. Специфічні IgG з'являються пізніше. Вони змінюють ранні антитіла IgM і накопичуються в організмі у великих кількостях. Під впливом антигену відбувається стимуляція В-клітин, що призводить до збільшення афінності IgG антитіл, низькою після першого контакту і зростаючої протягом наступних тижнів або місяців. Через місяць після інфікування аффинность IgG-антитіл зростає. Цей процес називається дозріванням антитіл. Високі дози антигену сприяють більш повільного зростання авідності, а низькі дози антигену - швидшому зростанню авідності. Отже, низькоавідних антитіла синтезуються протягом першого тижня інфекції, коли зміст антигену високе. Високоафінні антитіла довго присутні в організмі, забезпечуючи розвиток швидкого вторинної імунної відповіді при повторному контакті зі збудником.
Індекс авідності (ІА) антитіл визначають за допомогою ІФА та розраховують за формулою:
ІА \u003d -------------- * 100%,
де ОП 1 - оптична щільність в лунках з антигенами при обробці денатуруючих агентом;
ОП 2 - оптична щільність в лунках з тієї ж сироваткою після обробки розчином порівняння.
Виявлення в випробуваної сироватці антитіл з ІА нижче 30-50% вказує на свіжу первинну інфекцію. Показник ІА вище 50% свідчить про присутність в сироватці високоавідних антитіл - маркерів перенесеної в минулому інфекції.
Таблиця №2
Варіанти інтерпретації результатів серологічного обстеження хворих з ВЕБ-інфекцією
|
Стадія ВЕБ-інфекції |
низькоавідних антитіла |
EBNA-IgG |
|||
|
Інкубаційний період або відсутність інфекції |
|||||
|
Дуже рання первинна інфекція |
|||||
|
Рання первинна інфекція |
|||||
|
Гостра первинна інфекція (інф. Мононуклеоз) |
|||||
|
Пізня первинна інфекція |
|||||
|
хронічна інфекція |
|||||
|
Атипова первинна інфекція |
|||||
|
Рання past-інфекція |
|||||
|
Пізня past-інфекція |
|||||
|
реактивация |
Для оцінки основних показників противірусного захисту проводиться імунологічне обстеження системи інтерферону, рівня імуноглобулінів основних класів цитотоксичних лімфоцитів (СД8 +), Т-хелперів (СД4 +).
При ВЕБ-інфекції спостерігається два види змін імунного статусу: дисбаланс і недостатність окремих ланок імунної системи і підвищена активність інших. Імунна недостатність при цій інфекції проявляється зниженням здатності до стимульованої продукції ІФН-α або ИНФ-γ, дісіммуноглобулінеміі (зниження вмісту IgG, рідше IgA, підвищення вмісту IgM); зниженням авідності антитіл, зниженням змісту СД25 + лімфоцитів, зменшенням числа і функціональної активності СД16 +, Т-хелперів (СД4 +), цитотоксичних лімфоцитів (СД8 +), придушенням функціональної активності фагоцитів або зміною їх реакції на стимули, в тому числі на иммунокорригирующие препарати.
Ознакою напруженості противірусного імунітету можуть бути підвищені рівні ІФН-α в сироватці крові, IgA, IgM, IgE, ЦВК, нерідко - поява антитіл до ДНК, підвищення вмісту природних кілерів (СД16 +), Т-хелперів (СД4 +) або цитотоксичних лімфоцитів (СД8 +) . Система фагоцитозу може бути активована.
Біохімічні показники. У сироватці крові хворих виявляється підвищення рівня білків гострої фази, α2-глобулінів, СРБ, фібриногену, а також підвищення рівня трансаміназ, ЛДГ та інших ферментів. Однак перераховані зміни не є строго специфічними для ВЕБ-інфекції (їх можна виявити і при інших вірусних інфекціях).
Для детекції антигену вірусу (в сироватці крові, слині, кістковому мозку) використовується полімеразна ланцюгова реакція. Збіг позитивних даних полімеразної ланцюгової реакції та імуноферментного аналізу становить 92,5%. Найбільша інформативність методу ПЛР при виявленні в крові ДНК вірусу Епштейна-Барр та в змивах носоглотки досягається протягом 4 тижнів хвороби.
Лікування.Неонатальна персистирующая ВЕБ інфекція у дітей перших місяців життя, прояви якої безпосередньо пов'язані зі станом імунної системи, курується з використанням іммунооріентірованная терапії: ликопид і віферон. Призначення ликопида більшою мірою сприяє стабілізації гуморального ланки імунної відповіді. Ликопид рекомендується призначати у віковій дозі протягом 10 днів з 10-денною перервою і повторним прийомом в наступні 10 днів. Віферон-1 застосовується 2 рази в день в свічках протягом 10 днів і далі по 1 свічці на ніч протягом наступних 10 днів. Використання ликопида з віфероном надає нормалізує вплив переважно на клітинно-опосередкований імунітет. На тлі лікування Лікопід в поєднанні з віфероном знижувалася частота субфебрилитета і лімфопроліферативного синдрому. Надалі діти, які одержували поєднане лікування Лікопід з віфероном, за нашими спостереженнями, рідше хворіють на ГРВІ та обструктивним бронхітом.
Хворі діти з постнатальним інфекційний мононуклеоз повинні бути на щадному постільному режимі, з дотриманням теплових процедур на область збільшених лімфатичних вузлів. Харчування теплою напіврідкої їжею; якщо утруднене ковтання - полоскання горла відварами ромашки і шавлії.
Специфічна тропность вірусу Епштейна-Барр до імунокомпетентним клітинам, здатність вірусу до тривалої персистенції в організмі дітей визначають доцільність застосування иммунокорригирующих коштів в гострому періоді інфекційного мононуклеозу, крім стандартної антибіотикотерапії та симптоматичного лікування. клінічна практика показує ефективність використання інтерфероносодержащіх препаратів та індукторів інтерферону в терапії захворювання. Вибір препарату повинен визначатися в залежності від варіанту імунного реагування хворого. При визначенні у дитини «клітинного» варіанту імунної відповіді можна використовувати в терапії виферон (у вікових дозах) або людський лейкоцитарний інтерферон з лейкінфероном. При визначенні у дитини «гуморального» варіанту імунної відповіді краще використовувати поєднання людського лейкоцитарного інтерферону з лейкінфероном або доповнювати 10-денний курс віферона циклоферон (у вікових дозах). Після віферонотерапії в періоді ранньої реконвалесценції при схильності до бактеріальних інфекцій, слід призначати ликопид. Для лікування дітей з алергічною схильністю слід використовувати полиоксидоний. Пацієнтам, схильним до затяжного перебігу інфекційного мононуклеозу, рекомендується циклоферон.
Антибіотики пеніцилінового і цефалоспоринового ряду призначають дітям раннього віку при важких формах захворювання, при виражених некротичних змінах в зіві, різкому паличкоядерних зрушення в аналізі крові і при ускладненнях (отит, пневмонія). Місцево призначається обробка мигдалин розчином хімотрипсину. Симптоматична терапія інфекційного мононуклеозу включає в себе жарознижуючі, антигістамінні препарати.
При ускладнених формах інфекційного мононуклеозу (при обструкції дихальних шляхів, ускладнень з боку ЦНС, тромбоцитопенії) рекомендується використовувати глюкокортикоїдних гормони.
У зв'язку з тим, що інфекційний мононуклеоз супроводжується розвитком імунологічної недостатності з ураженням шлунково-кишкового тракту, використання антибіотиків при ускладнених формах мононуклеозу викликає зрушення в кишковому мікробіоценозе, показано призначення пробіотичних препаратів. Доцільно використовувати рідкий концентрат біфідобактерій «Біфідум 791 ПАГ». До складу цього універсального пробіотика входить симбиотический комплекс з трьох штамів біфідобактерій. «Біфідум 791 ПАГ» призначається курсом 10-15 днів. З перших днів лікування антибіотиками можна використовувати пробіотик «ЕКОФЛОРА», він забезпечує виведення мікробних токсинів з організму, знижує токсичне навантаження на печінку, нівелює токсичні ефекти від антибіотиків. Мікробіологічної основою «Екофлора» є консорціум біфідо-і лактобактерій, іммобілізованих на сорбенті СУМС-1, що дозволяє поліпшити захист біфідо-і лактобактерій при проходженні через шлунок. Із звільненням сорбенту від колоній бактерій починається відновлення кишкової середовища і очищення кишечника від токсинів, при цьому знижується ендогенна і екзогенна інтоксикація. «ЕКОФЛОРА» призначається дітям з 3 років, курс 10 днів.
Під впливом комплексної терапії з включенням пробіотиків відбувається достовірно швидше купірування основних симптомів захворювання, зниження температури, інтоксикації, накладень на мигдалинах, швидше знижується вміст в крові атипових мононуклеарів, активніше відновлюються змінені показники імунологічного статусу.
У зв'язку із з'ясуванням патогенетичних ланок розвитку аутоімунного хронічного гастриту, уточненням ролі ВЕБ в прогресуванні захворювання, відпрацьовані і методики його лікування. З метою придушення розмноження вірусу, створення антивірусного стану незаражених клітин, стимуляції фагоцитів і природних кілерів рекомендовано застосування інтерферонів. З препаратів інтерферонового ряду використовується виферон, лейкінферон, лейкоцитарний інтерферон. На тлі застосування інтерферонів підвищується рівень фагоцитарної активності моноцитів, збільшується кількість лімфоцитів CD3 +, CD8 +, що сприяє формуванню повноцінної імунної відповіді.
Для придушення розмноження вірусу в клітці використовуються аномальні нуклеотиди: валацикловир (валтрекс), ганцикловір (цимевен), фамцикловір (фамвір). Одним з найбільш часто застосовуються при лікуванні хронічної ВЕБ інфекції є валацикловір - специфічний інгібітор ДНК-полімерази вірусів герпесу. Він блокує синтез вірусної ДНК і реплікацію вірусів. В організмі людини валацикловір перетворюється в ацикловір і валін. В результаті фосфорилювання з ацикловіру утворюється активний трифосфат ацикловіру, який конкурентно інгібує вірусну ДНК-полімеразу. Перший етап фосфорилювання відбувається під впливом вірусспецифічного ферменту, який виявляється тільки в клітинах, інфікованих вірусом. Необхідність присутності вірусспецифічного ферменту для активації ацикловіру в значній мірі пояснює його селективність. Валацикловір активний відносно ВЕБ, ЦМВ і герпесу 1, 2 і 6.
У комплекс терапії включається виферон при хронічному гастриті з активною фазою ВЕБ інфекції, а при виявленні ДНК ВЕБ у біоптаті слизової оболонки шлунка - віферон в комбінації з валацикловіром. Ефективність противірусного лікування хронічного гастриту проявляється поліпшенням показників клітинного і гуморального імунітету, зникненням аутоантитіл до парієтальних клітинах шлунка і формуванням тривалої клініко-ендоскопічної ремісії. Більш стійкі результати лікування досягаються при використанні 3-тижневого курсу лікування валацикловіром в комбінації з інтерфероном по переривчастої програмі протягом 1,5-2 місяців. Значна ефективність виявляється у дітей при призначенні реаферон-ЄС-Ліпінт в дозі 250,000 од. 2 рази в день протягом 7 днів, далі призначається ½ терапевтичної дози протягом 3 тижнів.
При безперервно-рецидивуючому перебігу хронічного гастриту, що протікає з порушенням клітинного і гуморального імунітету, придушенням індукованого синтезу лейкоцитами крові ІФН-α і ИНФ-γ, показано включення в комплексне лікування дітей іммунокорректора лейкінферона в комбінації з людським лейкоцитарним інтерфероном і валацикловіром. Лейкинферон призначається внутрішньом'язово 3 рази на тиждень протягом перших 2 тижнів, потім 2 рази на тиждень протягом наступних 2 тижнів і далі у вигляді свічок 2-3 рази в тиждень протягом 2-3 тижнів (всього 10 свічок). З другого тижня підключається людський лейкоцитарний інтерферон внутрішньом'язово 2 рази на тиждень (на курс 10 ін'єкцій). Комплексна програма лікування сприяє нормалізації показників інтерферонового статусу, клітинного і гуморального імунітету, призводить до стійкої клініко-ендоскопічної ремісії.
Клінічний приклад.Андрій С., 2 років 5мес., Поступив в стаціонар 05.05.2007г. зі скаргами на високу t 0 - 39 0 С, одноразову блювоту, знижений апетит і рідкий стілець 5 раз на добу. Болен з 20.04.2007 ГРВІ, отримував амбулаторно симптоматичне лікування. До кінця другого тижня було поліпшення стану, але з 05.05.2007 рецидив лихоманки, t 0 - 38,8-39 0 C. Спрямований на госпіталізацію.
анамнез життя: Від 1 вагітності, протікала із загрозою викидня, нефропатією, прееклампсією під час пологів. Під час вагітності перенесла ОPВІ з лімфаденітом. Обстеження на пренатальні інфекції, виявляли антитіла класу IgG до ЦМВ і вірусу герпесу. Лікування не проводилося. Пологи в строк, маса при народженні 3500 г, довжина 51 см. До грудей прикладена відразу, смоктав активно, грудне годування до року, прикорм вводилися в 5 і 6 місяців. Адаптація до їжі нормальна. У вазі додавав досить, в 2г.5мес. - маса 14.810г, зростання 93 см.
Стан здоров'я протягом 1 року життя неблагополучне. Тривало трималася жовтяниця, у віці 3 тижнів: загальний білірубін - 315,1 мкмоль, непрямий - 297,3 мкмоль, прямий - 17,8 мкмоль. Одночасно з жовтяницею був нестійкі випорожнення. У копрограмме був нейтральний жир (++) і слиз (+). У посіві калу був виділений золотистий стафілокок, проводилося лікування ампіциліном всередину, потім стафілококовий фаг, біфідумбактерин. У 1-місячному віці неврологом встановлений діагноз перинатального ураження ЦНС, гіпоксично-ішемічного генезу, гіпертензійного синдром.
В 2 місяці - повторний висів з калу золотистого стафілокока в титрі 10 5 і гриби роду Candida albicans в титрі 10 4. Обстеження на ВУІ не проводилося. Призначалося лікування хилак-форте.
До 6 міс. віку були відзначені зміни в крові: гемоглобін - 112 г / л, еритроцити - 4,2 * 10 12 / л, лейкоцити - 7,8 * '10 9 / л, сегментоядерні нейтрофіли - 12%, лімфоцити - 67%, моноцити - 12 %, еозинофіли - 8%, базофіли - 1%, ШОЕ - 3 мм / год. У повторних аналізах крові в 2 півріччі продовжувала виявлятися нейтропенія. Консультував гематологом, встановлений діагноз доброякісної нейтропенії дитячого віку.
У 10 міс. в аналізі крові виявлена \u200b\u200bанемія (гемоглобін - 107 г / л, еритроцити - 3,81 * 10 12 / л, колірний показник - 0,84, тромбоцити - 280.000, сегментоядерні нейтрофіли - 11%, лімфоцити - 76%, моноцити - 90% , еозинофіли - 3%, базофіли - 1%). Гематологом призначено лікування СОРБІФЕР, курс 1 місяць.
В 1 рік в аналізі калу на дисбактеріоз виявлено дефіцит біфідо-і лактофлори, зростання Staph. aureus 10 5 і гриби роду Candida alb. 10 5.
Оглянутий ортопедом: відзначено обмежене відведення стегон. В 1 рік на УЗД органів черевної порожнини визначався перегин в області шийки жовчного міхура, холестаз.
Оглянутий генетиком, діагностована недиференційована дисплазія сполучної тканини з ураженням кістково-м'язової системи.
У 1г.5мес. переніс гострий ентероколіт неуточненої етіології, госпитализировался в стаціонар на 10 днів, отримував лікування ЕНТЕРОЛ і метронідазолом.
Протягом 1,5 років переносить часті ГРВІ з підвищенням t 0 до 38,8 0 протягом 3-4 днів і катаральними явищами.
об'єктивні дані при останньої госпіталізації: відзначалися явища назофарингита протягом 5 днів, лихоманка до 39 0 С 2 дня, шкірні покриви без висипки. При огляді - гіперемія зіву і збільшення підщелепних, передніх і задньошийної лімфовузлів, стілець прискорений до 3 разів на добу, з 5 дня лікування - оформлений. ЛОР-лікарем діагностовано хронічний тонзиліт і аденоїдит, в фазі загострення.
обстеження: В мазку з зіву - висів гемолитического стрептокока. Посіви на патогенну кишкову флору негативні. ІФА на ротавірус - негативний. РНГА з кишковими діагностикумами - негативні.
Аналіз крові при надходженні від 05.05.07: гемоглобін 104 г / л, еритроцити - 3,7 * 10 12 / л, колірний показник - 0,85, лейкоцити - 6,4 * '10 9 / л, паличкоядерні - 4%, сегментоядерні - 72 %, лімфоцити - 18%, моноцити - 4%, еозинофіли - 2%, ШОЕ - 4 мм / год.
Гемограми в динаміці: від 09.05.07 - гемоглобін - 109 г / л, еритроцити - 3,4 * 10 12 / л, лейкоцити - 7,8 * '10 9 / л, паличкоядерні - 19%, сегментоядерні - 42%, лімфоцити - 28% (шірокоплазменние лімфоцити), моноцити - 8%, плазматичні клітини - 1%, еозинофіли - 2%, ШОЕ - 13 мм / год. В надалі - червона кров залишалася без динаміки, число лейкоцитів не змінювався, наростав лимфоцитоз до 43% (Шірокоплазменние форми) і число моноцитів до 12%, ШОЕ підвищилася до 20 мм / год.
Аналіз сечі без відхилень від норми (5-кратно).
В біохімічному аналізі крові - помірна гипоальбуминемия, печінкові тести - в нормі.
Аналіз крові від 08.05.07: ІФА з мікоплазменним АГ - IgM і IgG - негативні, з герпес-вірусами IgM і IgG негативні, анти-ЦМВ - IgM - негативний, анти-ЦМВ IgG - позитивний, з хламідійним антигеном (хламідія пневмонії) - IgG в титрі 1:80 (хламідія trachomatis) - IgG - негативні. Маркери ДНК-ЦМВ в сечі не знайдені.
Реакція Гофф-Бауера від 07.05.07 - негативна.
Аналіз крові на ІФА на антигени вірусу Епштейна-Барр від 12.05. і 14.05.07: анти-ВЕБ IgM - негативний, IgGEA - позитивний і IgGNA - позитивний (\u003e 0,5 од.). Сукупність даного аналізу свідчила про пізньої первинної (мононуклеозной) інфекції.
Таким чином, на основі ретроспективної оцінки анамнезу дитини стає зрозумілим, що у пацієнта, інфікованого з народження вірусом цитомегалії і хламідіями, протягом першого і другого року життя інфекція персистувати і як наслідок - була пролонгована жовтяниця, спостерігалося ураження органів дихання у вигляді «масок» багаторазових ГРВІ та кишечника з епізодами дисфункцій, формуванням дисбактеріозу і імунодефіцитного стану. Ураження центральної нервової системи зареєстровано неврологом в ранні терміни (У віці 1 місяця). На користь вірусної персистенції свідчив постійний лимфоцитоз і як наслідок - нейтропенія, що дуже часто недооцінюється консультантами-гематологами і не призначається вірусологічне тестування пацієнтів. Після 2 років на тлі персистуючої хламідійної-цитомегаловірусної інфекції нашарувалася постнатальная інфекція ВЕБ, що в сукупності у ослабленого дитини в подальшому може викликати персистирующую мікст-інфекцію (ЦМВ + хламідія + ВЕБ).
Не можна не звернути увагу на відсутність настороженості у педіатрів навіть при настільки неблагополучному пренатальному анамнезі на можливість внутрішньоутробної або перинатальної інфекції у дитини як в перші тижні, так і в наступні місяці його життя.
Після проведеного обстеження хворому була призначена комплексна терапія (ликопид + виферон) в поєднанні з пробиотиком (біфіформ).
На сьогоднішній день медицина досягла рівня, при якому багато вірусні захворювання, які раніше вважалися невиліковними, перестали бути вироком. Однак до сих пір існують такі, від яких люди не можуть повністю позбутися. До них відноситься і вірус Епштейна - Барр (ВЕБ). З одного боку, він досить нешкідливий, тому що з часом захисна система організму виробляє до нього імунітет. З іншого - може викликати страшні ускладнення у вигляді онкологічних захворювань. Особливу небезпеку становить тим, що заражаються їм в дуже ранньому віці. Як проявляється ВЕБ у дітей? Які наслідки?
Що таке вірус Епштейна - Барр?
Тривимірне зображення вірусу Епштейна - Барр
За хитромудрою назвою ховається збудник інфекційного мононуклеозу - вірус, що провокує появу «хвороби поцілунків». Своє цікаве прізвисько він отримав через те, що в більшості випадків зараження відбувається через слину.
Вірус Епштейна - Барр (ВЕБ) - один з представників сімейства вірусів герпесу 4-го ступеня. Самий маловивчений і одночасно поширений. Приблизно 90% жителів усієї планети є носіями в латентній або активній формі і потенційними джерелами інфікування, при тому, що даний бактеріофаг вважається менш заразним, ніж добре всім відома застуда.
Вчені довели, при одноразовому попаданні в організм вірус залишається в ньому назавжди. Так як повністю вивести його неможливо, в більшості випадків ВЕБ просто переводять в «спляче» стан, використовуючи пригнічують препарати.
Інфекційний мононуклеоз відомий людству досить давно. Вперше він був описаний в кінці XIX століття і отримав назву залозистої лихоманки, тому що супроводжувався збільшенням лімфовузлів, печінки і селезінки на фоні підвищеної температури. Пізніше його помітив хірург Д. П. Беркітта і зафіксував близько 40 випадків зараження, працюючи в Африканських країнах. Але все прояснити вдалося тільки в 1964 році двом англійським вірусологів Майклу Епштейна і Івонне Барр (асистентка доктора). Вони виявили герпесвірус в зразках пухлини, висланими Беркітта спеціально для дослідження. В їх честь вірус і отримав свою назву.
способи інфікування

Поцілунок - один із способів зараження ВЕБ
В основному інфікування вірусом відбувається ще в дитячому віці. Близько 90% людей, що вступають в контакт з дитиною, здатні його заразити. Групу ризику складають новонароджені до 1 року. За статистичними даними, 50% дітей в країнах, що розвиваються отримують вірус від матері в грудному віці. А вже до 25 років цей показник зростає до 90%. Найчастіше ВЕБ діагностується в період від чотирьох до п'ятнадцяти років.
Те, як виявляється хвороба, не залежить від статі і раси: і хлопчики, і дівчатка страждають нею в однаковій мірі і з однаковою частотою. Але варто знати, що в районах, де переважає населення з низьким достатком, герпесвірус більш поширений, проте протікає в прихованій формі протягом майже 3 років.
Способи зараження:
- контактний. Зі слиною через обійми або поцілунки. Найбільша кількість вірусних частинок знаходиться в клітинах поряд зі слинних залоз і виділяється разом з нею;
- повітряно-крапельний. Збудник збирається в слизових оболонках зіва, носа і носоглотки і верхніх дихальних шляхах і виділяється на поверхню при чханні, зевании, кашлі, крику і навіть простому розмові;
- при переливанні крові від донора. Дана маніпуляція не настільки рідкісна. Уже в пологовому будинку дитині можуть її призначити, якщо виявлена \u200b\u200bанемія (низький гемоглобін) або дитина народжена раніше запланованої дати при певних обставинах;
- при трансплантації кісткового мозку від донора. Методика застосовується не тільки при онкологічних захворюваннях, Але і недугах, пов'язаних з кров'ю людини (анемія, геморагічні діатези).
Важливо розуміти, що у 25% переносників вірус в слині знаходиться постійно. Це, в свою чергу, говорить про те, що вони є носіями і джерелами інфекції навіть при відсутності явних симптомів протягом всього свого життя.
Симптоми у дітей
зазвичай Інкубаційний період триває від 4 тижнів до 1-2 місяців. Причому якщо дитина дуже маленький (до 3 років), то симптоми можуть і зовсім ніяк не виявитися. Але спільними для малюків будуть наступні провісники хвороби, які тримаються в середньому 10-14 днів:
- Втома і дратівливість. Малюк часто плаче, а проблему не вдається знайти.
- Збільшено лімфатичні вузли. Мама може виявити ущільнення або відчутні горбки, наприклад, в районі шийки і у вушок. У важких випадках - по всьому тілу.
- Порушення травлення і відмова від їжі.
- Висип. Не варто плутати з алергічними реакціями на певні продукти і дерматит. В даному випадку вона буде схожа на висип, як при скарлатині.
- Сильний фарингіт і висока температура (39-40С °).
- Болі в животику. Це відбувається через збільшення печінки і селезінки.
- Біль в горлі і погіршення дихання. У гострій фазі, як правило, збільшуються аденоїди.
- Жовтяниця. Але це дуже рідкісний симптом і зустрічається нечасто.
Багато симптоми нагадують ангіну, і тим небезпечніше самолікування, так як прийом антибіотиків пеніцилінового ряду тільки посилить хвороба і висип.
Вірус Епштейна - Барр в залежності від території поширення проявляє себе по-різному. У європейській частині населення серед основних симптомів: температура, набрякання лімфовузлів. У жителів Китаю, особливо південних районів, хвороба здатна спровокувати рак носоглотки. У районах Африки герпесвірус може викликати злоякісну пухлину (лімфому Беркітта).
Симптоми хвороби (галерея)
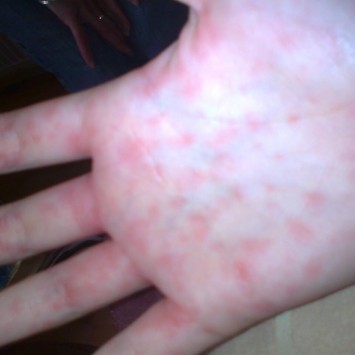
 збільшені лімфовузли
збільшені лімфовузли  дратівливість
дратівливість 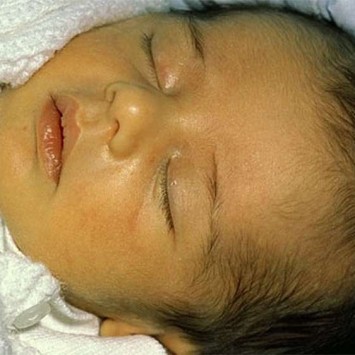 жовтяниця
жовтяниця  Висока температура
Висока температура
діагностика
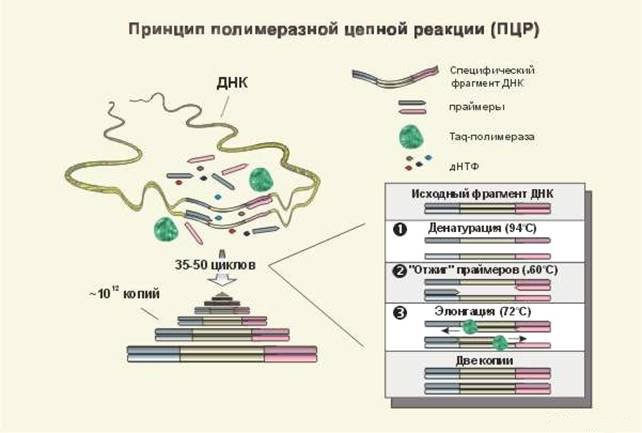
Для діагностірвоанія ВЕБ застосовують метод ПЛР
Для діагностування вірусу у хворого використовують лабораторні методи. Найбільш поширені наведені в наступній таблиці:
| вид дослідження | коли призначають | Характеристика / показники |
| Загальний аналіз крові |
Первинне дослідження при підозрі:
|
Виявляється підвищення числа лейкоцитів, тромбоцитів або, навпаки, зниження кількості тромбоцитів до 150 × 109 / л, лімфомоноцитоз з атиповими мононуклеарами більше 10%. |
| Біохімічний аналіз крові |
|
Підвищення значень АлАТ, АсАТ, лужної фосфатази, білірубіну. |
| іммунограмма |
Так як зрушення в показниках можуть говорити про різні захворювання, на які реагує імунна система. |
Виявляється відсоткове співвідношення клітин імунної системи (лейкоцитів, фагоцитів, моноцитів і ін.), І на основі результатів імунолог порівнює їх з показниками норми. |
|
серологічний
аналіз |
|
Виявлення антитіл IgG (з'являються вже після зіткнення з антигеном) до VCA, IgM (першими виробляються при контакті з мікробами), Anti-EBV, EBV EA-IgG Ab. Однак антитіла класу IgG до EBNA залишаються в організмі на все життя і їх наявність не говорить про активність вірусу. |
| Метод ПЛР (полімеразної ланцюгової реакції) для ДНК - діагностики |
|
Відсоток помилки майже зведений до нуля. Визначається по слині або крові шляхом багаторазового розмноження різних ділянок ДНК і РНК. Шукається «бракований» ген. |
Труднощі або, скоріше, особливість діагностики полягає в тому, що перші три види досліджень говорять про загальних показниках і не виявляють саме вірус Епштейна - Барр. Останні - більш точні, але призначаються лікарями нечасто. Своєчасне діагностування мононуклеозу допоможе уникнути ускладнень і сприяє його швидкого згасання.
Лікування дитини в домашніх умовах

Дитина, що знаходиться на лікуванні
Для початку необхідно звернутися до лікаря, щоб визначити, як вірус Епштейна - Барр взаємодіє з організмом малюка. Якщо останній тільки носій і немає ніяких клінічних ознак, то лікування не призначається.В іншому випадку дитину поміщають в інфекційний стаціонар або ж лікування проводиться амбулаторно.
Спеціальних коштів, як і вакцини, не існує. Зазвичай імунна система сама справляється, але якщо є ризик ускладнень, то прописується комплексна терапія противірусними засобами:
- «Ацикловір» або «Зовіракс» до 2 років. Тривалість: 7-10 днів;
- «Віферон 1» у формі ректальних свічок дітям до 7 років;
- «Циклоферон» малюкам вводиться ін'єкційно;
- «Інтрон А», «Роферон - А», «Реаферон - ЄС», якщо хвороба знаходиться в хронічній стадії.
При цьому важливо дотримуватися ряду розпоряджень:
- дотримуватися постільного режиму;
- уникати фізичних навантажень як мінімум місяць навіть після поліпшення;
- пити більше рідини, щоб уникнути інтоксикації;
- приймати жарознижуючі (Панадол, Парацетамол) і антигістамінні ліки ( «Тавегіл», «Феністил»), а також вітаміни, особливо вітамін С (можна давати лимонну водичку);
- полоскати горло різними відварами (шавлія, ромашка) або фурациліном;
- закапувати ніс судинозвужувальними препаратами. Але варто пам'ятати, що вони викликають звикання. Тому не слід ними користуватися довше 3 днів.
Всі ці пункти повинні виконуватися тільки після огляду педіатром. Не потрібно займатися самолікуванням. навіть використання народних засобів може викликати серйозні наслідки у малюка.
Так як під час протікання інфекційного мононуклеозанарушен обмін білків, жирів і вуглеводів, а також ослаблена імунна система, то показана спеціальна дієта, Яка полягає у вживанні:
- свіжих овочів;
- солодких ягід;
- нежирної риби (минтая, тріски). Її краще варити або готувати на пару;
- пісного м'яса (яловичини, кролика);
- крупи (гречки, вівсянки);
- хлібобулочних виробів (краще підсушених);
- молочних продуктів (твердого сиру, сиру).
Можливо введення в раціон яєць, але не більше одного в день. Слід уникати вживання жирної їжі. Солодке треба їсти в помірних кількостях.
 В овочах містяться вітаміни, які допомагають підтримати імунну систему
В овочах містяться вітаміни, які допомагають підтримати імунну систему  У гречці корисні мікроелементи і вітаміни, які допомагають організму в боротьбі з хворобою
У гречці корисні мікроелементи і вітаміни, які допомагають організму в боротьбі з хворобою  У фруктах містяться вітаміни, які допомагають підтримати імунну систему
У фруктах містяться вітаміни, які допомагають підтримати імунну систему  У підсушеному хлібі містяться складні вуглеводи
У підсушеному хлібі містяться складні вуглеводи  Необхідно вживати сир, так як в ньому міститься білок
Необхідно вживати сир, так як в ньому міститься білок  У яловичині знаходиться багато білка і невеликий вміст жиру
У яловичині знаходиться багато білка і невеликий вміст жиру
Чи потрібен карантин
Лікування зазвичай передбачає, що дитина буде перебувати вдома певний час, як і при будь-якій застуді. Якщо обставини вимагають (наприклад, багато виховні установи не допускають пропусків відвідування без пред'явлення довідки від лікаря), то лікар дає лікарняний приблизно на 12 днів, що припадають на гостру фазу хвороби. Карантин не потрібно.
прогноз одужання
Прогноз при зараженні вірусом досить сприятливий в тому випадку, якщо:
- дитина не страждає імунними захворюваннями;
- проводились профілактичні заходи з раннього віку;
- призначено якісне лікування
- хвороба не була запущена;
- відсутні ускладнення.
Вірус активізується при ослабленій або виснаженої імунній системі, інтоксикації.
Повністю вивести вірус Епштейна - Барр неможливо. Його просто переводять в «сплячий режим». Тому батькам варто знати, планова вакцинація здатна пробудити недуга. Завжди необхідно попереджати лікаря, що дитина перенесла мононуклеоз. Крім цього, слід регулярно проходити планові огляди і здавати відповідні аналізи.
можливі ускладнення
Анемія як варіант ускладнення
У разі відсутності якісного і своєчасного лікування, можливий розвиток ускладнень. Найбільш поширеними є:
- анемія. Виникає через зниження в крові еритроцитів, лейкоцитів і тромбоцитів. Іноді супроводжується гемоглобинурией і жовтяницею;
- ураження центральної нервової системи (Енцефаліт і менінгіт);
- ураження черепних нервів, що призводить до синдрому Мартіна - Белл (затримка психомоторного розвитку), мієліту, нейропатії та ін .;
- отит і гайморит;
- утруднене дихання внаслідок збільшення лімфатичних вузлів;
- розрив селезінки (якщо хворий перестарається з фізичними навантаженнями під час протікання хвороби);
- гепатит, який має швидкий характер протікання.
До специфічних належать:
- проліферативний синдром. В основному характерний для людей, які вже мають імунні хвороби. За короткий проміжок часу кількість В-лімфоцитів збільшується, що призводить до порушень в роботі багатьох внутрішніх органів. Дуже небезпечна вроджена форма, так як смерть дитини виникає ще до звернення до лікаря. У тих, кого медики встигають врятувати, пізніше діагностуються різні форми анемії, лімфоми, гипогаммаглобулинемия, агранулоцитоз;
- волохата лейкоплакія рота. Мовою і внутрішній стороні щік з'являються горбки. Часто це один з перших симптомів ВІЛ-інфекції;
- злоякісні пухлини: лімфома Беркітта, недиференційований рак носоглотки, рак мигдаликів.
Доктор Комаровський про інфекційному мононуклеозі (відео)
профілактика ВЕБ
Вірус досить поширений, тому уникнути зараження їм майже неможливо. Але є і позитивна сторона: навіть при інфікуванні в дорослому віці імунітету людини вдається виробити необхідні антитіла для боротьби.
вакцина на наразі знаходиться на стадії розробки, тому найдієвішим способом є систематичне і комплексне зміцнення імунітету:
- холодну загартовування з ранніх років, гуляння на свіжому повітрі;
- прийом вітамінів. Тут варто сказати, що тільки лікар повинен призначати вітамінні комплекси. В іншому випадку це не зміцнить імунітет, а лише підірве здоров'я;
- збалансоване харчування. Як відомо, близько 80% клітинних елементів імунної системи знаходяться в кишечнику, тому необхідно грамотне планування раціону: вживання достатньої кількості фруктів і овочів. Слід уникати продуктів з барвниками і хімічними добавками;
- своєчасне і якісне лікування соматичних захворювань. Не захоплюйтеся самолікуванням, навіть якщо ви вважаєте, що знаєте, чим хворієте, слід пам'ятати, багато недуг добре маскуються і протікають зі схожими симптомами. Особливо актуально це для дітей;
- більше рухайтеся. Спорт потрібно прищеплювати з ранніх років. Крім хорошого імунітету, У дитини буде відмінне фізичний і психологічний стан;
- уникайте стресів;
- рідше відвідуйте суспільні місця.
Профілактичні заходи (галерея)
 загартовування малюка
загартовування малюка  прийом вітамінів
прийом вітамінів  Збалансоване харчування
Збалансоване харчування  Заняття спортом
Заняття спортом
Як і багато інших захворювань, вірус Епштейна - Барр страшний своїми наслідками. Батькам потрібно проявляти особливу пильність і уважно стежити за самопочуттям дитини. У разі виявлення будь-яких симптомів, відразу ж звернутися до лікаря. Краще зайвий раз перестрахуватися, ніж потім використовувати сильнодіючі препарати і комплексну терапію. Здоров'я вам і вашому малюкові!
Вірус Епштейна-Барр. крім цього іменований людським герпес вірусом 4 типу, є одним з найбільш поширених вірусів людини. Поселяється він здебільшого в епітеліальних клітинах носоглотки і в В-лімфоцитах (різновид лейкоцитів білих клітин крові). Джерело інфекції хвора людина, а також і хворі стертими формами хвороби. Передача інфекції відбувається повітряно-крапельним шляхом, але частіше зі слиною (наприклад, при поцілунках), можлива передача інфекції при переливанні крові. Від моменту зараження до перших показників захворювання (інкубаційний період) проходить в середньому від 30 до 50 днів. Велика частина людей інфіковані ВЕБ, але у них відсутні будь конкретно або симптоми. Прояви Епштейна-Барр вірусної інфекції багатоликі. Хвороб, з якими він асоційований, безліч. Найчастіше вірус Епштейна-Барр є обставиною походження інфекційного мононуклеозу, синдрому хронічної втоми. Останнім часом з'являється все більше даних підтверджують участь ВЕБ в розвитку деяких онкопроцесу (назофарінгіальная карцинома, лімфома і т.д.).
інфекційний мононуклеоз характеризується тріадою показників великою температурою тіла, ангіною, підвищенням лімфатичних вузлів; печінки і селезінки. Для синдрому хронічної втоми властиві постійна втома і зниження працездатності у раніше здорових людей при відсутності явних хвороб або інших обставин, якісь зможуть привести до такого стану. Поряд з цим зможуть відзначатися підвищена температура тіла (до 38 градусів), хронічний фарингіт, збільшення лімфатичних вузлів, м'язові і суглобові болі, порушення сну.
Для чого потрібен аналіз на вірус ЕпштейнаБарр?
При плануванні вагітності рекомендується пройти комплексне обстеження на наявність в організмі герпетичної інфекції, а також і герпес 4 типу (ВЕБ), і провести адекватне лікування під контролем лікаря. Це пов'язано з тим, що для вагітних страшнішою є обстановка, в той час, коли у жінки до настання вагітності не було контакту з ВЕБ, ніж в разі якщо дама раніше перенесла зустріч із цим вірусом. Якраз перше знайомство організму з цим вірусом, якщо воно відбувається на протязі вагітності, може завдати непоправної шкоди перебігу вагітності та формування малюка.
Аналізи на вірус вірус ЕпштейнаБарр, завдяки яким можливо з'ясувати наявність вірусу ЕпштейнаБарр в організмі людини є:
Імуноферментний аналіз на вірус вірус Епштейн - Барр з визначенням антитіл IgG, IgM до капсидному антигену (VCA), IgG до раннього антигену (EA) і IgG до ядерного антигену (ЕВNA).
Що таке ІФА-аналіз на вірус вірус Епштейна-Барр? Це лабораторне вивчення, в якому особливими біохімічними реакціями вдається з'ясувати вміст у крові імуноглобулінів (або антитіл).
Що таке імуноглобуліни (антитіла) в аналізі на вірус Епштейна-Барр? Це білки, якісь виробляються клітинами крові. При попаданні в людський організм збудника (антигену) тієї або іншої інфекції імуноглобуліни з ним зв'язуються (утворюють комплекс) і через деякий час нейтралізують. скільки є різних мікробів, вірусів і токсинів, стільки й існує різних імуноглобулінів. Разом з кров'ю вони зможуть потрапляти в будь-які, крім того найвіддаленіші куточки нашого організму і всюди наздоганяти агресорів.
Що таке антитіла IgM до капсидному антигену (VCA) в аналізі на вірус Епштейна-Барр? Антитіла класу IgM до капсидному антигенною комплексу вірусу Епштейна-Барр властиві для гострої інфекції. Вони з'являються в ранній фазі захворювання і зникають протягом 4 - 6 тижнів від початку гострої первинної інфекції. Даний тип антитіл виявляється крім цього і при реактивації (відновлення течії) інфекції.
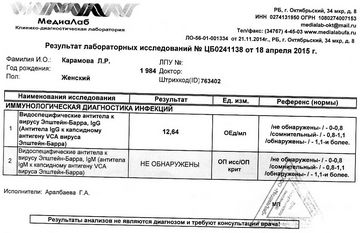
Що таке антитіла IgG до капсидному антигену (VCA) в аналізі на вірус Епштейна-Барр? VCA IgG з'являються практично відразу після VCA IgM і в гострій стадії інфекції виявляються фактично у всіх хворих. Після закінчення одужання VCA IgG зберігаються довічно. При реактивації інфекції кількість цих антитіл зростає.
Що таке антитіла IgG до раннього антигену (ЕА) в аналізі на вірус Епштейн - Барр? Ранні антигени (EA) з'являються в ранню фазу життєвого циклу вірусу при гострій первинної інфекції, і при реактивації інфекції вірусом Епштейна-шкірний покрив. Антитіла класу IgG до ранніх антигенів при гострому інфекційному мононуклеозі з'являються на 1ої 2ий тижня інфекції і зникають в середньому через 3 - 4 (до 6) місяця. Як правило присутність антитіл до ранніх антигенів вірусу Епштейна-Барр в аналізі на вірус Епштейна-Барр характерно для гострої інфекції.
Що таке антитіла IgG до ядерного антигену (ЕВNA)? Ці антитіла в аналізі на вірус Епштейна-Барр є показником минулого в минулому інфекції (т.н.паст - інфекції) вірусом Епштейна-Барр. Антитіла класу IgG до ядерного антигену (IgG-EBNA-антитіла) з'являються через 4 - 6 місяців після закінчення початку інфекції, а також і протікає в стертих формах, а після цього, в маленьких кількостях, виявляються довічно. Їх можливо знайти у понад 50% підлітків і більше 90% дорослих людей. IgG-EBNA-антитіла в аналізі на вірус Епштейна-Барр виявляються на пізніх термінах після закінчення гострої інфекції, на тлі безсимптомної інфекції, і при реактивації і хронічної інфекції.
Як розшифрувати підсумок аналізу на вірус вірус Епштейна- Барр?
При розшифровці ІФА аналізу на вірус вірус Епштейна-Барр потрібно враховувати, що будь-яка лабораторія, яка проводить такий аналіз, має свої показники норми (т.зв. референсні значення). Вони повинні бути вказані на бланку. При рівні антитіл нижче порогового значення свідчать про негативний результат, вище порогового значення позитивному.
Полімеразна ланцюгова реакція на виявлення ДНК вірусу Епштейн Барр.
Що таке ДНК вірусу? Мова заходить про добре всім відомої дезоксирибонуклеїнової кислоти. Вона міститься в вірусу і є носієм його спадкової інформації. За ДНК, як за відбитками пальців, нереально сплутати один вірус з іншим.
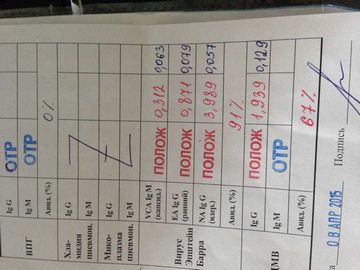
Що таке ПЛР аналіз на вірус вірус Епштейн - Барр? Це надчутливий спосіб лабораторної діагностики інфекційних хвороб. Він заснований на виявленні у взятому на вивчення матеріалі (це можливо кров, сеча, навколоплідні води, мокрота, слина і т.д.) ДНК або РНК збудника інфекції. Для ПЛР діагностики вірусу Епштейн Барр найчастіше матеріалом для вивчення є венозна кров.
Як розшифрувати підсумок аналізу на вірус вірус Епштейн - Барр? ПЛР в більшості випадків дає позитивний (збудник є) або негативний результат (збудника немає). ПЛР аналіз на вірус Епштейн Барр дозволяє розпізнати крім того мізерно мала кількість вірусу.

У той час, коли призначають такий аналіз на вірус вірус Епштейн - Барр? ПЛР діагностика вірусу Епштейн Барр є додатковим способом підтверджує гостру стадію інфекції. Використання ПЛР для діагностики, перенесеної в минулому або хронічної інфекції не потрібно. ПЛР-тестування особливо корисно для виявлення даної інфекції у новонароджених, в той час, коли ІФА вивчення малоїнформатівни завдяки незрілості імунної системи.
Підготовка до ІФА і ПЛР аналізам на вірус вірус Епштейн - Барр: Специфічною підготовки до вивчення не потрібно. Потрібно здавати кров натщесерце; незадовго до направлятися уникати прийому жирної їжі.
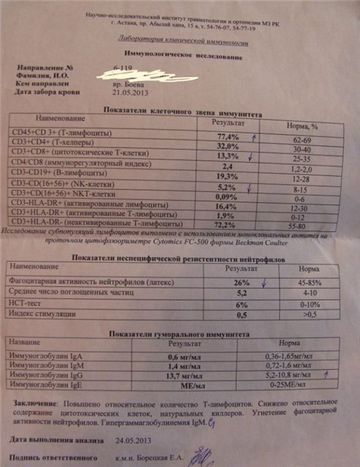
- Гексетидин.
- Стопангин.
- Гексорал.
- Тантум Верде.
- Йокс.
- Мірамістин.
Місцеве лікування антисептиками і дезінфікуючими препаратами показано в разі приєднання вторинної інфекції. При інфекційному мононуклеозі тонзиліт асептичний.
Препарати для лікування горла з больовим синдромом:
- ТераФлю ЛАР - спрей і таблетки з антисептиком і дезинфікуючим средством.Содержіт лідокаїн і м'яту перцеву.
- Стрепсілс Плюс - таблетки і спрей. Препарат містить антисептик, дезінфікуючий речовина і лідокаїн.
- стрепсилс Інтенсив — таблетки, що містять флурбипрофен (НПЗЗ), що володіють анальгезирующим і протизапальну дію.
- флурбіпрофен - таблетки, що містять нестероїдні протизапальні засоби (НПЗЗ). Має протизапальну і знеболюючу дію.
- Тантум ® Верде - розчин, спрей, таблетки. Містить бензидамін, що володіє місцево анестезуючу дію, знімає біль і набряк слизової оболонки.
- Анти-Ангін Формула - таблетки і пастилки. Містить антисептик хлоргексидин і місцево анестезуючу речовину тетракаїн.
- Нео-ангін — таблетки. Містить антисептики, дезінфікуючі засоби і ментол.
- каметон- аерозоль. Містить антисептик хлорбутанолу гідрат, камфору, ментол, евкаліптова олія.
препарати місцевої дії, Що містять в своєму складі знеболюючі компоненти, не можна застосовувати дітям до 3-х років через небезпеку розвитку у них ларингоспазма
Лікування хронічної вірус Епштейна-Барр-інфекції
Іммуннокоректори
- З метою корекції імунного статусу хворого застосовуються препарати інтерферони-альфа, часто в поєднанні з індукторами інтерферонів. Вони сприяють створенню в здорових клітинах антивірусної готовності, пригнічують розмноження вірусів, стимулюють роботу природних клітин-вбивць і фагоцитів.
- Імуноглобуліни призначаються в разі важкого перебігу вірус Епштейна-Барр- інфекції. Ці препарати блокують «вільні» віруси, які знаходяться в крові, лімфі і міжклітинної рідини.
- Препарати вилочкової залози ( Тимоген, Иммунофан, Тактивин та ін.) - препарати з Т-активує дію і здатністю стимулювати фагоцитоз.
лікування вірус Епштейна-Барр інфекції препаратами коректорами і стимуляторами імунітету проводиться тільки після імунологічного обстеження хворого і вивчення його імунного статусу.
противірусні препарати
Лікування вірус Епштейна-Барр-інфекції противірусними препаратами показано при неефективності препаратів інтерферонів. Хіміопрепарати пригнічують синтез вірусної ДНК, в результаті чого припиняється процес реплікації вірусів у клітині. Доказової активністю в даний час володіють противірусні препарати - аналоги нуклеозидів: Ацикловір (Зовіракс), Валацикловір (Валтрекс), Пенцикловір (Вектавір), Фамцикловір (Фамвір). Курс лікування противірусними препаратами становить 14 днів.
гормональні препарати
Преднізолон, гідрокортизон і дексаметазон призначаються при тяжкому перебігу інфекції - обструкції дихальних шляхів, неврологічних і гематологічних ускладненнях. Препарати цієї групи зменшують запалення і оберігають органи від ушкодження.
цитостатики
Цитостатики зменшують реплікацію вірусів.
антибактеріальні препарати
У разі приєднання вторинної інфекції призначаються антибактеріальні препарати. При вірус Епштейна-Барр-інфекції частіше виявляється, стрептококи, стафілококи, гриби роду Candida. Препаратами вибору є цефалоспорини 2 - 3 поколінь, макроліди і протигрибкові препарати. При змішаній мікрофлорі показаний препарат метронідазол.





